Abstrak
LATAR BELAKANG
Dengan perkembangan teknologi enzim dan jangkauan penggunaannya yang luas, protease telah menjadi salah satu kelompok enzim industri yang penting di pasaran. Oleh karena itu, ada kebutuhan berkelanjutan untuk mengeksplorasi produsen protease baru guna memenuhi berbagai permintaan dalam industri. Penelitian ini bertujuan untuk mengoptimalkan dan memodelkan produksi protease oleh Bacillus licheniformis NRS 1264, serta untuk mengkarakterisasi sebagian enzim tersebut.
HASIL
Studi karakterisasi menunjukkan nilai suhu dan pH optimum enzim masing-masing sebesar 55 °C dan 5,5. Ditemukan pula bahwa keberadaan 5 mmol L −1 MnSO4 meningkatkan aktivitas protease hingga 37%, sedangkan jumlah yang sama dari CoCl2 dan EDTA menurunkan aktivitas masing-masing sebesar 20% dan 37%. Selain itu, enzim mempertahankan 95% dari aktivitas maksimumnya bahkan setelah 30 hari penyimpanan pada suhu 4 °C. Lebih jauh lagi, hasil studi optimasi menunjukkan konsentrasi glukosa, pepton dan kasein optimum dalam media produksi masing-masing sebesar 1,25, 7,20 dan 10,98 g L −1 . Dalam kondisi ini, aktivitas enzim maksimum diukur sebesar 5078 U mL −1 , yang kira-kira empat kali lipat lebih tinggi dibandingkan dengan nilai aktivitas enzim terendah yang diperoleh dalam percobaan satu faktor pada satu waktu. Akhirnya, studi pemodelan menunjukkan bahwa model Gompertz yang dimodifikasi merepresentasikan produksi protease lebih berhasil dibandingkan dengan model logistik yang dimodifikasi dengan memiliki lebih sedikit kesalahan dan nilai R 2 , faktor bias, dan faktor akurasi yang mendekati 1.
KESIMPULAN
Ini adalah studi unik yang memberikan perluasan pengetahuan tentang potensi produksi enzim protease yang sangat ampuh ini di tingkat industri. © 2025 Penulis. Jurnal Teknologi Kimia dan Bioteknologi diterbitkan oleh John Wiley & Sons Ltd atas nama Society of Chemical Industry (SCI).
PERKENALAN
Istilah protease muncul pada akhir abad kesembilan belas untuk merujuk pada enzim yang memecah protein. 1 Protease dikenal sebagai enzim proteolitik yang mengkatalisis pemecahan ikatan peptida dalam protein dan polipeptida. 2 Protease memiliki peran penting dalam banyak proses fisiologis dan biokimia in vivo seperti fungsi protein, metabolisme sel, pertumbuhan, diferensiasi, motilitas, pembelahan, kematian, dan modifikasi pascatranslasi. 3 , 4 Protease juga umum digunakan dalam berbagai bidang industri seperti pengolahan makanan, produksi deterjen, tekstil, manajemen lingkungan, teknik kimia, aplikasi medis, dan farmakologi. 5 – 10
Sumber utama protease adalah hewan, tumbuhan, dan mikroorganisme. Namun, produksi protease yang berasal dari hewan dan tumbuhan menghadapi beberapa keterbatasan kritis seperti penyembelihan, area penanaman, pertumbuhan yang lambat, serta faktor politik dan pertanian. 11 Oleh karena itu, masalah-masalah ini telah mengarahkan produsen untuk menggunakan mikroorganisme untuk produksi protease. Di antara sumber protease mikroba, produsen bakteri seperti Bacillus spp. khususnya menyediakan sebagian besar permintaan protease global. 12 Salah satu keuntungan paling signifikan dari genus ini adalah kapasitas tinggi untuk sekresi protein. 13 Selain itu, protease Bacillus memiliki beberapa karakteristik berharga untuk banyak aplikasi biologis seperti aktivitas pH dan suhu yang luas, stabilitas, toleransi senyawa toksik, dan dapat digunakan untuk rekayasa protein. 13 , 14 Oleh karena itu, identifikasi karakteristik spesifik dari protease yang diproduksi penting untuk penentuan area aplikasi industri yang tepat dari enzim tersebut.
Selain itu, tidak hanya pemilihan produsen seluler tetapi juga optimalisasi kondisi produksi merupakan kriteria penting dalam bioproses untuk meningkatkan kinerja sistem dalam hal hasil, produktivitas dan umur panjang, mengurangi biaya lain seperti biaya, waktu, energi dan limbah, dan meningkatkan kualitas produk. 15 Untuk tujuan ini, satu faktor pada satu waktu (OFAT) umumnya digunakan sebagai langkah pertama dasar sebelum optimalisasi berdasarkan evaluasi satu faktor sambil menjaga semua kondisi lain tetap konstan. 16 Metode ini umumnya diikuti dengan strategi optimalisasi lebih lanjut dan terperinci seperti desain eksperimen untuk penentuan faktor yang dievaluasi optimal. Selain itu, representasi produksi biologis oleh model matematika memainkan peran penting dalam memberikan informasi tentang kinetika produksi. 17 Secara keseluruhan, dalam penelitian ini optimalisasi dan pemodelan produksi protease oleh Bacillus licheniformis NRS 1264 bersama dengan karakterisasi parsial enzim dipelajari secara rinci untuk memberikan wawasan tentang potensi produksi enzim pada skala industri.
BAHAN DAN METODE
Persiapan inokulum dan media produksi
Media inokulum disiapkan dengan melarutkan 1 g glukosa, 2 g KH 2 PO 4 , 3 g ekstrak daging, 10 g pepton, 10 g kasein dan 5 g NaCl per liter dalam air suling. 18 Setelah mengatur pH menjadi 8 dengan larutan NaOH pekat, 50 dan 100 mL larutan ditambahkan ke dalam labu kocok 250 untuk inokulum dan media produksi, masing-masing. Media yang disiapkan disterilkan pada suhu 121 °C selama 15 menit. B. licheniformis NRS 1264 beku (diperoleh dari USDA Agricultural Research Service, IL USA) dalam botol 1 mL, yang disumbangkan oleh Associated Prof. Müge İşleten dari Gebze Teknik University, dicairkan di atas es. Setelah itu, 1 mL (2% v/v) alikuot sel ditambahkan ke dalam labu inokulum 50 mL. Labu diinkubasi pada suhu 37 °C dan 150 rpm selama 24 jam. Labu produksi diinokulasi dengan larutan inokulum pada 1% (v/v) hingga memiliki konsentrasi awal 106 sel mL −1 dan diinkubasi pada suhu 37 °C dan 150 rpm selama 48 jam.
Persiapan dan implementasi media agar selektif
Agar selektif, yang umumnya digunakan untuk mendeteksi dan membedakan strain bakteri berdasarkan kemampuannya untuk menghasilkan enzim tertentu, disiapkan seperti yang dijelaskan dalam literatur dengan sedikit modifikasi. 19 Media agar selektif terdiri dari bahan-bahan yang sama seperti media produksi kecuali penambahan 5 g glukosa dan 15 g agar per liter dalam air suling. Setelah mengatur pH menjadi 8, larutan diautoklaf pada 121 °C selama 15 menit. Setelah itu, media didinginkan hingga sekitar 50 °C dan kemudian dituang dalam cawan petri steril 25 mL dalam lemari aliran laminar. Agar yang telah dipadatkan ditaburkan di tempat dengan 2 μL sampel bakteri, yang diambil dari media inokulum. Setelah inokulasi, cawan petri diinkubasi pada 30 °C selama 24 jam. Zona pertumbuhan proteolitik dan bakteri diukur pada akhir inkubasi.
Pengukuran aktivitas protease
Aktivitas protease diukur menggunakan metode yang dijelaskan dalam literatur dengan sedikit modifikasi untuk mengadaptasi protokol dengan kondisi khusus penelitian ini. 20 Sampel (5 mL) yang diambil dari kaldu produksi ditempatkan dalam tabung falcon 15 mL dan disentrifugasi pada 11.000 × g pada suhu 4 °C selama 10 menit. Larutan enzim bebas sel (0,5 mL) ditambahkan ke dalam 2,5 mL larutan kasein 0,6% yang disiapkan dalam 50 mmol L −1 pH 6,5 buffer fosfat dan dipanaskan terlebih dahulu hingga 55 °C dalam penangas air. Setelah 20 menit inkubasi, 2,5 mL asam trikloroasetat 0,44 mol L −1 ditambahkan ke setiap tabung untuk menghentikan reaksi dan campuran diinkubasi pada suhu kamar selama 10 menit. Selanjutnya, tabung disentrifugasi pada 11.000 × g pada suhu 4 °C selama 10 menit dan 0,25 mL supernatan diambil ke dalam tabung baru. Setelah itu, 1,25 mL 0,5 mol L −1 Na 2 CO 3 dan 0,25 mL reagen Folin–Ciocalteu ditambahkan ke dalam setiap tabung dan campuran diinkubasi dalam lingkungan gelap selama 30 menit dan kemudian nilai absorbansi diukur secara spektrofotometri pada 600 nm. Satu unit enzim (U) didefinisikan sebagai jumlah enzim yang akan menghasilkan 1 μmol tirosin per menit dan pada suhu 55 °C. Media produksi yang tidak diinokulasi digunakan sebagai blanko untuk pengukuran aktivitas protease secara spektrofotometri.
Penentuan suhu dan pH optimal protease
Untuk menentukan suhu dan nilai pH optimum protease, larutan enzim direaksikan dengan larutan substrat kasein pada berbagai suhu (4, 20, 30, 40, 50, 55, 60, 65 dan 70 °C) dan pH (5, 5,5, 6, 6,5, 7, 7,5 dan 8). Setelah melakukan langkah-langkah pengukuran aktivitas enzim, nilai aktivitas protease relatif dihitung.
Pengaruh berbagai bahan kimia terhadap aktivitas protease
Efek berbagai bahan kimia pada aktivitas protease diuji dengan mereaksikan enzim dengan larutan kasein 0,6% pada pH 6,5 termasuk 5 mmol L −1 CuSO4 , ZnSO4 , FeSO4 , MgSO4, MnSO4 , EDTA , CaCl2 , CoCl2 atau KCl. Secara berbeda, 600 mmol L −1 NaCl ditambahkan ke larutan kasein untuk mewakili air laut. Dalam percobaan ini, larutan enzim tanpa penambahan bahan kimia apa pun digunakan sebagai kontrol dan media fermentasi yang tidak diinokulasi sebagai blanko. Aktivitas protease relatif dihitung dalam kondisi yang sesuai.
Pengaruh suhu penyimpanan terhadap aktivitas protease
Untuk tujuan mempelajari pengaruh suhu penyimpanan dan kondisi durasi terhadap aktivitas protease, sampel enzim dimasukkan ke dalam tabung Eppendorf 1,5 mL dan disimpan pada suhu -20, 4, dan 25 °C selama 30 hari. Sampel diambil dari setiap kondisi penyimpanan setiap 3 hari dan aktivitas enzim diukur.
Implementasi OFAT
Dalam percobaan OFAT, sembilan labu disiapkan termasuk komposisi kimia yang sama seperti media produksi normal tetapi mengubah konsentrasi glukosa, pepton dan kasein (5, 10 atau 20 g L −1 ) yang dianggap memainkan peran penting dalam produksi protease. Sampel disiapkan dalam labu 250 mL termasuk 100 mL medium dan pH disesuaikan menjadi 8 secara terpisah. Kemudian, labu disterilkan pada 121 °C selama 15 menit. Setelah pendinginan, 5 mL medium fermentasi yang tidak diinokulasi dikumpulkan dari setiap labu ke dalam tabung steril untuk digunakan sebagai blanko yang sesuai selama pengukuran aktivitas enzim. Setelah itu, inokulasi 1% (v/v) dibuat ke dalam labu dan diinkubasi pada 37 °C dan 150 rpm selama 48 jam. Sampel diambil dari setiap tabung dan disentrifugasi pada suhu 4 °C dan 11.000 × g selama 10 menit. Supernatan digunakan dalam pengukuran aktivitas protease.
Optimasi dengan desain Box–Behnken dan validasi kondisi
Dalam studi optimasi produksi protease, pertama batas bawah dan atas konsentrasi glukosa, pepton dan kasein ditetapkan masing-masing sebesar 1–6, 2,5–7,5 dan 7,5–12,5 g L −1 , berdasarkan hasil yang diperoleh dari percobaan OFAT. Secara total, 15 labu disiapkan berdasarkan desain Box–Behnken dalam MiniTab 17.1.0 dan aktivitas enzim diukur pada 48 jam produksi. Setelah itu, analisis varians (ANOVA) dilakukan dan persamaan prediksi matematis dibuat. Selanjutnya, fungsi optimasi diterapkan pada hasil, dan tiga produksi labu replikasi dijalankan pada kondisi optimum untuk memvalidasi hasil.
Pemodelan matematika
Tiga tabung replikasi dijalankan dalam kondisi optimum dan sampel diambil secara berkala selama 48 jam. Analisis enzimatik dilakukan dan grafik aktivitas protease rata-rata terhadap waktu diplot. Model Gompertz yang dimodifikasi dan persamaan model logistik yang dimodifikasi, yang rumusnya diberikan di bawah ini, digunakan dalam percobaan pemodelan. 21
Model Gompertz yang dimodifikasi:

Pada model-model tersebut, A t adalah aktivitas protease (U mL −1 ) pada waktu t , A m adalah asimtot atas, Q adalah laju produksi maksimum (U mL −1 h −1 ), λ adalah waktu tunda (h), e adalah bilangan Euler (2,718) dan t adalah waktu pengambilan sampel (h).
Analisis statistik
ANOVA model regresi untuk produksi protease dilakukan menggunakan MiniTab 17.1.0. Perbandingan model matematika dilakukan dengan mengevaluasi nilai-nilai seperti root mean square error (RMSE), mean absolute error (MAE), faktor bias ( B f ) dan faktor akurasi ( A f ), koefisien regresi ( R 2 ) dan slope menggunakan Microsoft® Excel® for Microsoft 365 MSO. Model matematika sebaiknya memiliki nilai RMSE dan MAE yang rendah dan nilai A f , B f , R 2 dan slope mendekati 1.
HASIL DAN PEMBAHASAN
Media agar selektif
Setelah inkubasi B. licheniformis NRS 1264 pada agar selektif selama 24 jam, koloni bakteri dan zona bening karena aktivitas proteolitik diamati seperti yang ditunjukkan pada Gambar 1. Rasio radius zona bening dan radius koloni bakteri dihitung sebagai 2. Pengukuran semikuantitatif metodologi produksi protease ini juga telah digunakan dalam penelitian lain dalam literatur. Dalam salah satu dari penelitian tersebut, kemampuan produksi protease dari dua strain Bacillus yang berbeda dievaluasi menggunakan berbagai substrat seperti susu bubuk, kasein dan gelatin dalam agar selektif. Rasio diameter zona bening/diameter koloni di antara strain dan substrat yang dievaluasi dilaporkan antara 0 dan 2. 22 Itu juga merupakan kasus bahwa hasil kami adalah salah satu nilai tertinggi dibandingkan dengan hasil dalam literatur.

Suhu dan pH optimal protease
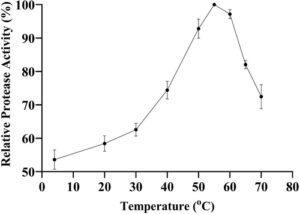
Dalam penentuan suhu optimum percobaan enzim, sembilan kondisi suhu yang berbeda diuji. Menurut nilai aktivitas relatif (Gbr. 2 ), suhu optimum enzim ditetapkan sebesar 55 °C. Diamati bahwa enzim menunjukkan aktivitas maksimum lebih dari 50% bahkan pada suhu 4 °C. Pada suhu yang lebih tinggi, aktivitas meningkat tajam terutama setelah 30 °C dan mencapai maksimum pada suhu 55 °C. Tercatat pula bahwa nilai aktivitas relatif enzim pada suhu 50 dan 60 °C tidak banyak berubah (sekitar 3–7% lebih rendah) dibandingkan dengan kondisi suhu optimum. Namun, penurunan sebesar 18% dan 28% dihitung dalam nilai aktivitas relatif masing-masing pada suhu 65 dan 70 °C. Perbandingan dengan penelitian lain dalam literatur menunjukkan bahwa suhu optimum protease B. licheniformis P003 dinyatakan pada 50 °C dan, serupa dengan hasil kami, ditunjukkan bahwa enzim mempertahankan 78% dari aktivitas maksimumnya pada 70 °C. 23 Dalam penelitian produksi protease oleh B. thuringiensis 24 dan B. cereus AUST-7, 25 suhu optimum enzim dinyatakan persis sama dengan hasil kami, yaitu 55 °C. Sekali lagi serupa dengan hasil kami, suhu optimum untuk protease yang diproduksi dari B. licheniformis LBA 46 dilaporkan pada 50 dan 60 °C. 26 Juga, dalam penelitian lain, suhu optimum protease B. licheniformis ATCC 21424 dihitung pada 60 °C. 27 Berbeda dengan hasil kami, dalam penelitian yang dilakukan dengan B. licheniformis 018, suhu optimum yang lebih rendah untuk aktivitas protease dihitung sebesar 35 °C. 16 Selain itu, dalam penelitian menggunakan B. licheniformis K7A, suhu optimum dilaporkan sebesar 70 °C. 28 Dengan mempertimbangkan pengaruh nilai suhu terhadap aktivitas protease dalam penelitian ini, kekuatan dan stabilitas enzim menjadi jelas. Protease ini dapat berhasil digunakan dalam aplikasi suhu tinggi dan rendah seperti binatu, industri makanan, dan remediasi kimia perairan terbuka alami.
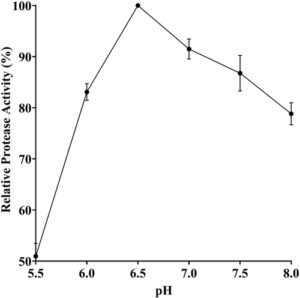
Untuk mengevaluasi efek pH pada aktivitas protease, enam nilai pH yang berbeda diuji. Nilai pH optimum enzim ditetapkan sebesar 6,5 (Gbr. 3 ). Diamati bahwa enzim mempertahankan 50% dan 83% dari aktivitas tertingginya pada pH 5,5 dan 6,0, berturut-turut. Selain itu, aktivitas relatif menurun hanya sebesar 9% pada pH 7. Lebih jauh lagi, enzim mempertahankan aktivitas relatifnya sebesar 86% dan 78% pada pH 7,5 dan 8, berturut-turut. Dalam literatur terdapat beberapa penelitian yang tersedia mengenai investigasi pH optimum protease Bacillus . Dalam salah satu penelitian ini, nilai pH optimum protease B. subtilis 38 dinyatakan sebesar 6,5, serupa dengan hasil kami. Namun, aktivitas relatif protease ini menurun tajam pada nilai pH yang lebih tinggi, dihitung sebesar 50% dan 0% pada pH 7,5 dan 8,5, berturut-turut. 29 Di sisi lain, dalam beberapa penelitian lain, nilai pH optimum yang lebih tinggi dari protease yang diproduksi oleh B. licheniformis LBA 46, 26 B. licheniformis strain 018, 16 B. licheniformis K7A 28 dan B. licheniformis P003 23 masing-masing dinyatakan sebagai 8,5, 9, 10 dan 10. Beberapa penelitian tersebut juga menunjukkan bahwa protease dapat menunjukkan karakteristik optimum yang berbeda, tidak hanya bergantung pada sumber mikrobanya tetapi juga pada substrat yang bereaksi dengannya. 30
Pengaruh berbagai bahan kimia terhadap aktivitas protease
Tujuan keseluruhan dari mengevaluasi efek dari berbagai bahan kimia pada aktivitas protease adalah untuk menyelidiki kemungkinan mekanisme pengaturan dan untuk mengkarakterisasi respons enzim terhadap modulator tertentu, yang berkontribusi untuk memahami kinetika dan sifat fungsionalnya. Efek dari bahan kimia yang dievaluasi pada aktivitas protease ditunjukkan pada Gambar 4. Menurut hasilnya, aktivitas protease relatif bervariasi antara 62% dan 137% tergantung pada efek bahan kimia. Ditunjukkan pada Gambar 4 bahwa aktivitas protease ditingkatkan dengan adanya 5 mmol L −1 CuSO4 dan MnSO4 masing -masing sebesar 105% dan 137%. Di sisi lain, EDTA ditentukan sebagai bahan kimia yang paling menghambat protease di antara yang dievaluasi. Namun, bahkan dengan adanya 5 mmol L −1 EDTA, yang dikenal sebagai agen khelasi yang kuat, protease mampu mempertahankan aktivitas maksimumnya pada 62%. Setelah EDTA, CoCl2 menunjukkan efek penghambatan kedua paling banyak pada enzim dan menyebabkan penurunan 20% dalam aktivitas relatif. Juga terbukti bahwa 90% nilai aktivitas enzim relatif dihitung dengan adanya 5 mmol L −1 ZnSO4 , FeSO4 dan MgSO4 , yang merupakan polutan umum dalam air limbah industri logam. Selain itu, adanya KCl menurunkan aktivitas protease relatif sebesar 7%. Juga ditentukan bahwa adanya 5 mmol L −1 CaCl2 dan 600 mmol L −1 NaCl hanya menyebabkan 1% dan 3 % penurunan aktivitas protease relatif. Terutama menunjukkan ketahanan terhadap konsentrasi garam tinggi yang mirip dengan air laut, protease ini memiliki potensi yang kuat untuk digunakan dalam aplikasi air asin seperti remediasi kimia di tambak ikan.
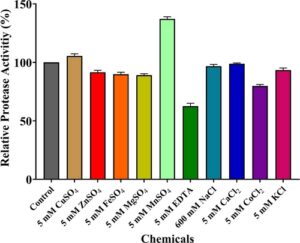
Ada beberapa penelitian yang tersedia dalam literatur mengenai efek berbagai bahan kimia pada aktivitas protease. Dalam salah satu penelitian ini, dilaporkan bahwa aktivitas relatif protease BG1 B. cereus ditingkatkan hingga 450%, 285% dan 157% dengan adanya Ca 2+ , Mg 2+ dan Mn 2+ , berturut-turut. Di sisi lain, aktivitas protease dihambat hingga 65%, 72% dan 100% dengan penambahan Cu 2+ , Zn 2+ dan EDTA, berturut-turut, dalam media reaksi. 30 Dalam penelitian lain mengenai penghambatan EDTA pada protease yang diproduksi dari B. amyloliquefaciens , disimpulkan bahwa enzim kehilangan sekitar 50% aktivitasnya dengan adanya 5 mmol L −1 EDTA. 31 Dalam studi lain, para peneliti mengevaluasi efek 1 mmol L −1 EDTA dan berbagai kation bivalen pada protease alkali termostabil dari B. megaterium TK1. Ditunjukkan bahwa aktivitas protease dihambat hingga 10% dengan adanya EDTA. Dilaporkan juga bahwa Na + , Mn 2+ , Ca 2+ dan Mg 2+ meningkatkan aktivitas enzim masing-masing hingga 55%, 23%, 20% dan 11%. 32 Dalam studi lain, para peneliti menyelidiki efek ion logam dan EDTA pada aktivitas protease yang diproduksi oleh Bacillus sp. Telah ditunjukkan bahwa aktivitas protease relatif meningkat hingga 130%, 116% dan 109% pada keberadaan Ca 2+ , Mg 2+ dan Co 2+ masing-masing sebesar 5 mmol L −1 , sedangkan pada keberadaan Fe 3+ , K + , Mn 2+ dan Na + masing-masing sebesar 5 mmol L −1 menurunkan aktivitas protease hingga 2%, 6%, 20% dan 40 %. Selain itu, juga dinyatakan bahwa aktivitas protease tidak berubah bahkan pada keberadaan EDTA 10 mmol L −1.33 Penelitian lain dilakukan untuk menyelidiki pengaruh berbagai ion logam pada aktivitas protease yang dihasilkan oleh B. licheniformis A10. Dilaporkan bahwa sementara Ca 2+ tidak menyebabkan perubahan yang nyata dalam aktivitas protease, K + , Mg 2+ dan Mn 2+ meningkatkan aktivitas tetapi kehadiran Fe 2+ , Ni 2+ , Zn 2+ , Ag + dan Co 2+ menurunkan aktivitas enzim. 34 Dalam sebuah penelitian baru-baru ini, efek dari berbagai bahan kimia pada 1 mmol LKonsentrasi −1 pada protease B. velezensis dievaluasi dan dilaporkan bahwa keberadaan Cu 2+ meningkatkan aktivitas relatif hingga 100 kali lipat. 35 Efek diferensial bahan kimia pada aktivitas protease yang dilaporkan dalam literatur terutama muncul dari variasi dalam struktur enzim, kebutuhan kofaktor, dan mekanisme interaksi. Efek ini juga bergantung pada strain, yang menyoroti pentingnya evaluasi empiris untuk setiap sistem protease tertentu.
Pengaruh suhu penyimpanan terhadap aktivitas protease
Stabilitas enzim yang dimurnikan sebagian merupakan isu kritis terutama dalam aplikasi industri dalam hal biaya keseluruhan karena enzim dengan kemurnian tinggi cukup mahal. 23 Oleh karena itu, stabilitas aktivitas enzim diuji dengan menyimpan sampel enzim pada tiga suhu berbeda dan aktivitas diukur setiap 3 hari selama periode 30 hari. Seperti terlihat pada Gambar 5 , tidak ada penurunan aktivitas enzim relatif yang diamati hingga hari kesembilan untuk sampel yang disimpan pada suhu 4 °C. Untuk sampel yang disimpan pada suhu -20 °C, kehilangan aktivitas yang tajam tercatat (17%) bahkan pada pengambilan sampel pertama. Penurunan cepat ini dapat dijelaskan oleh potensi kerusakan akibat munculnya kristal es dalam sampel enzim. Namun, untuk sampel yang disimpan pada suhu -20 °C, nilai aktivitas tetap hampir sama bahkan pada akhir 30 hari. Selain itu, sampel yang disimpan pada suhu 25 °C mempertahankan aktivitasnya sebesar 98% pada akhir penyimpanan selama 3 hari. Hasil ini menunjukkan bahwa enzim yang dihasilkan mampu mempertahankan aktivitasnya bahkan pada suhu kamar untuk penyimpanan jangka pendek, yang memberikan keuntungan ekonomi dalam hal komersial. Akan tetapi, aktivitas enzim terus menurun selama durasi penyimpanan selanjutnya dan kehilangan aktivitas sebesar 25% tercatat pada akhir penyimpanan selama 30 hari pada suhu 25 °C. Hasil keseluruhan dengan jelas menunjukkan bahwa penyimpanan kurang dari 30 hari pada suhu 4 °C merupakan pilihan yang tepat; akan tetapi, meskipun terjadi penurunan tajam pada aktivitas protease, kondisi −20 °C menghasilkan stabilitas yang lebih tinggi dalam aktivitas enzim relatif dalam kondisi penyimpanan jangka panjang.
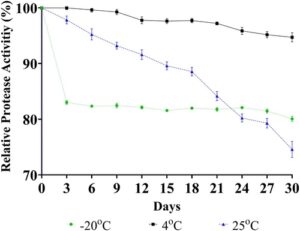
Dalam salah satu penelitian dalam literatur, efek kondisi penyimpanan pada protease B. licheniformis P003 diteliti. Larutan enzim disimpan pada suhu 25 dan 4 °C selama 28 hari dan dilaporkan bahwa nilai aktivitas dipertahankan pada 46% dan 66%, berturut-turut. 23 Dalam penelitian lain, peneliti meneliti efek imobilisasi pada aktivitas protease B. licheniformis dalam kondisi penyimpanan 4 °C dan menunjukkan bahwa enzim yang diimobilisasi mempertahankan aktivitas maksimumnya selama 20 hari. 36 Selain itu, dalam penelitian produksi protease jamur dilaporkan bahwa protease yang disimpan pada suhu 30 °C hanya mempertahankan 38% dari aktivitas maksimumnya pada akhir 30 hari penyimpanan. 37
Percobaan OFAT
OFAT adalah metode awal untuk digunakan sebelum studi optimasi terperinci. Untuk menentukan data awal untuk percobaan optimasi lebih lanjut, desain OFAT dengan 9 kali percobaan disiapkan dengan berbagai konsentrasi glukosa, pepton dan kasein dalam media produksi protease (Tabel 1 ). Nilai aktivitas protease diukur untuk setiap labu pada 48 jam. Nilai aktivitas protease yang diperoleh disajikan dalam Tabel 1. Terlihat bahwa aktivitas tertinggi diperoleh pada percobaan 1 (2694 U mL −1 ) yang melibatkan konsentrasi glukosa terendah (5 g L −1 ), dan aktivitas terendah diukur pada percobaan 7 (1220 U mL −1 ) dengan konsentrasi kasein terendah (5 g L −1 ). Selain itu, aktivitas protease pada run 3 diukur sebesar 1389 U mL −1 , yang mana konsentrasi glukosa berada pada level tertinggi (20 g L −1 ), mendekati nilai aktivitas pada run 7. Perbandingan run 1, 2 dan 3 menunjukkan bahwa dengan meningkatnya konsentrasi glukosa, aktivitas protease menurun drastis. Sebaliknya, seperti yang terlihat pada run 7, 8 dan 9, aktivitas protease meningkat dengan konsentrasi kasein yang lebih tinggi dalam media produksi. Khususnya, perbandingan run 7 dan 8 menunjukkan bahwa ketika konsentrasi kasein berubah dari 5 menjadi 10 g L −1 , aktivitas protease ditingkatkan hingga 75%. Namun, pada konsentrasi kasein 20 g L −1 (percobaan 9), aktivitas protease hanya meningkat sebesar 12% dibandingkan dengan kasein 10 g L −1 pada percobaan 8. Selain itu, diketahui bahwa aktivitas protease tidak berubah secara signifikan dengan perubahan jumlah pepton (percobaan 4, 5, dan 6). Evaluasi keseluruhan hasil pada Tabel 1 menunjukkan bahwa untuk studi optimasi lebih lanjut, kadar glukosa rendah, kadar kasein tinggi, dan kadar pepton sedang harus diteliti.
| Nomor lari | Glukosa (g L −1 ) | Pepton (g L −1 ) | Kasein (g L −1 ) | Aktivitas protease (U mL −1 ) |
|---|---|---|---|---|
| 1 | 5 | 10 | 10 | 2694 |
| 2 | 10 | 10 | 10 | tahun 1788 |
| 3 | 20 | 10 | 10 | tahun 1389 |
| 4 | 10 | 5 | 10 | tahun 1788 |
| 5 | 10 | 10 | 10 | tahun 1902 |
| 6 | 10 | 20 | 10 | tahun 2078 |
| 7 | 10 | 10 | 5 | tahun 1220 |
| 8 | 10 | 10 | 10 | tahun 2132 |
| 9 | 10 | 10 | 20 | tahun 2380 |
Optimasi dengan desain Box–Behnken
Dalam penelitian ini, pemodelan Box–Behnken digunakan untuk menentukan konsentrasi glukosa, pepton dan kasein yang optimum untuk produksi protease oleh B. licheniformis NRS 1264. Dengan mempertimbangkan hasil yang diperoleh dalam percobaan OFAT, interval konsentrasi glukosa, pepton dan kasein ditetapkan untuk rancangan Box–Behnken sebagai 1–6, 2,5–7,5 dan 7,5–12,5 g L −1 , berturut-turut, seperti yang disajikan dalam Tabel 2 . Dari 15 kali percobaan rancangan Box–Behnken, aktivitas enzim tertinggi (4808,22 U mL −1 ) diperoleh dari kali percobaan ke-9 yang meliputi 1 g L −1 glukosa, 7,5 g L −1 pepton dan 10 g L −1 kasein. Selain itu, aktivitas protease terendah yang diukur sebesar 2367,57 U mL −1 diperoleh pada run 10 yang berisi 6 g L −1 glukosa, 5 g L −1 pepton dan 7,5 g L −1 kasein dalam media produksi. Secara umum serupa dengan hasil OFAT, nilai aktivitas yang lebih tinggi dari 4400 U mL −1 dihitung untuk labu yang mencakup kadar kasein sedang atau tinggi dan kadar glukosa sedang atau rendah (run 4, 5, 8, 9, 11, 13). Selain itu, hasil aktivitas enzim yang sedikit berbeda diperoleh untuk kondisi yang sama (run 5, 11, 13), yang diasumsikan sebagai keacakan biologis. Selain itu, efek dari berbagai konsentrasi glukosa, pepton dan kasein pada aktivitas protease disajikan sebagai plot permukaan pada Gambar 6 . Seperti yang ditunjukkan pada Gambar 6(A),(B) , aktivitas protease menurun tajam pada konsentrasi glukosa yang lebih tinggi, khususnya di atas 4 g L −1 . Selain itu, Gambar 6(A),(C) menunjukkan bahwa tingkat konsentrasi pepton menengah optimal untuk memaksimalkan aktivitas protease. Lebih jauh lagi, Gambar 6(B),(C) dengan jelas menunjukkan bahwa konsentrasi kasein yang lebih tinggi dalam media produksi sangat penting untuk mencapai aktivitas enzim yang lebih tinggi. Seperti yang disajikan dalam Tabel 3 , ANOVA digunakan untuk menghitung nilai P untuk glukosa, pepton dan kasein dengan nilai masing-masing 0,001, 0,001 dan 0,000, yang menunjukkan bahwa semua faktor yang dievaluasi ini memiliki efek signifikan pada produksi protease oleh B. licheniformis NRS 1264 ( P < 0,05). Selain itu, nilai lack-of-fit, yang mengacu pada perbedaan antara model statistik dan data yang diamati dihitung sebagai tidak signifikan ( P = 0,140). Rumus matematika untuk desain Box–Behnken untuk produksi protease diberikan dalam Persamaan ( 3 ):
| Nomor lari | Glukosa (g L −1 ) | Pepton (g L −1 ) | Kasein (g L −1 ) | Aktivitas protease (U mL −1 ) |
|---|---|---|---|---|
| 1 | 6.0 | 5.0 | 12.5 | 3509.36 |
| 2 | 6.0 | 2.5 | 10.0 | 3334.16 |
| 3 | 1.0 | 5.0 | 7.5 | 3569.77 |
| 4 | 1.0 | 5.0 | 12.5 | 4463.87 |
| 5 | 3.5 | 5.0 | 10.0 | 4723.64 |
| 6 | 3.5 | 2.5 | 7.5 | 2663.59 |
| 7 | 3.5 | 2.5 | 12.5 | 3110.64 |
| 8 | 3.5 | 7.5 | 12.5 | 4687.40 |
| 9 | 1.0 | 7.5 | 10.0 | 4808.22 |
| 10 | 6.0 | 5.0 | 7.5 | 2367.57 |
| 11 | 3.5 | 5.0 | 10.0 | 4560.83 |
| 12 | 1.0 | 2.5 | 10.0 | 3835.58 |
| 13 | 3.5 | 5.0 | 10.0 | 4602.82 |
| 14 | 6.0 | 7.5 | 10.0 | 3618.10 |
| 15 | 3.5 | 7.5 | 7.5 | 3261.67 |

| Sumber | Derajat kebebasan | Jumlah kuadrat yang disesuaikan | Kuadrat rata-rata yang disesuaikan | F | P |
|---|---|---|---|---|---|
| Model | 9 | 8 666 886 | 962 987 | Tanggal 32.08 | 0,001 |
| Linier | 3 | 5 232 673 | 1 744 224 | 58.10 | 0.000 |
| Glukosa (g L −1 ) | 1 | 1 851 136 | 1 851 136 | 61.66 | 0,001 |
| Pepton (g L −1 ) | 1 | 1 471 825 | 1 471 825 | 49.03 | 0,001 |
| Kasein (g L −1 ) | 1 | Nomor telepon 1 909 713 | Nomor telepon 1 909 713 | 63.61 | 0.000 |
| Persegi | 3 | Nomor telepon 3 060 846 | Nomor telepon 1 020 282 | 33,99 | 0,001 |
| Glukosa (g L −1 ) × Glukosa (g L −1 ) | 1 | 430 809 | 430 809 | 14.35 | 0,013 |
| Pepton (g L −1 ) × Pepton (g L −1 ) | 1 | 557 002 | 557 002 | 18.55 | 0,008 |
| Kasein (g L −1 ) × Kasein (g L −1 ) | 1 | 2 421 179 | 2 421 179 | 80.65 | 0.000 |
| Interaksi dua arah | 3 | 373 367 | 124 456 | 4.15 | 0,080 |
| Glukosa (g L −1 ) × Pepton (g L −1 ) | 1 | 118 577 | 118 577 | 3.95 | 0.104 |
| Glukosa (g L −1 ) × Kasein (g L −1 ) | 1 | 15 338 | 15 338 | 0.51 | 0,507 tahun |
| Pepton (g L −1 ) × Kasein (g L −1 ) | 1 | 239 453 | 239 453 | 7.98 | 0,037 hari |
| Kesalahan | 5 | 150 106 | Nomor telepon 30 021 | ||
| Kurangnya kecocokan | 3 | 135 776 | 45 259 | 6.32 | 0.140 |

di mana nilai glukosa, pepton dan kasein dinyatakan dalam g L −1 .
Selain itu, nilai R 2 , R 2 yang disesuaikan dan nilai R 2 yang diprediksi untuk persamaan matematika dihitung sebesar 98,30%, 95,23% dan 75%, yang cukup tinggi untuk produksi biologis. Nilai-nilai ini juga secara jelas menunjukkan keberhasilan ekspresi untuk signifikansi faktor-faktor yang dievaluasi. Lebih jauh, alat optimasi dalam desain Box-Behnken menentukan konsentrasi glukosa, pepton dan kasein optimum masing-masing sebesar 1,25, 7,20 dan 10,98 g L −1 , dan aktivitas protease tertinggi dalam kondisi ini diprediksi sebesar 5127,97 U mL −1 (Gbr. 7 ).
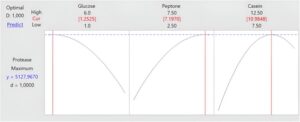
Untuk memvalidasi kondisi optimum, tiga tabung replikasi dijalankan pada kondisi optimum dan aktivitas protease pada 48 jam produksi dihitung sebesar 5038, 5056 dan 5140 U mL −1 . Rata-rata nilai ini dihitung sebesar 5078 U mL −1 dan perbedaan kecil antara nilai eksperimen yang diprediksi dapat dijelaskan oleh keacakan biologis. Akhirnya, kami dapat menyimpulkan validasi kondisi optimum dengan jumlah perbedaan yang dapat diterima.
Pemodelan
Produksi protease bakteri diwakili oleh dua model matematika yang berbeda, yaitu model Gompertz yang dimodifikasi dan model logistik yang dimodifikasi. Selama analisis aktivitas protease eksperimental, sampel sering diambil dari media produksi untuk memungkinkan identifikasi parameter yang kuat, yang selanjutnya akan digunakan dalam perhitungan pemodelan matematika. Semua parameter yang dihitung tersebut disajikan dalam Tabel 4. Nilai aktivitas protease eksperimental dan yang diprediksi disajikan dalam Tabel 5 .
| Parameternya | Nilai |
|---|---|
| Sebuah angka 0 | 3,44 U ml -1 |
| Sebuah saya | 5067,99 U ml -1 |
| Q | 194.326 U mL −1 jam −1 |
| 𝜆 | 4 jam |
| Waktu (h) | Aktivitas protease eksperimental (U mL −1 ) | Gompertz yang dimodifikasi (U mL −1 ) | Logistik yang dimodifikasi (U mL −1 ) |
|---|---|---|---|
| angka 0 | 3.44 | 81.981 | 346.01 |
| 0.1 | 45.73 | 85.563 | 350,99 |
| 1 | 154.47 | 123.306 | 398.86 |
| 2 | 194.74 | 178.119 | 458.98 |
| 4 | 255.15 | 334.427 | Nomor telepon 604.12 |
| 6 | 537.08 | 557.720 | 787.31 |
| 8 | 867.33 | 844.774 | 1013.43 |
| 10 | 1255.98 | 1183.415 | 1285.01 |
| 12 | 1701.02 | 1555.929 | 1600.63 |
| 16 | 2421.94 | 2327.110 | 2332.34 |
| 20 | 3001.90 | 3034.213 | 3099.53 |
| 24 | 3521.44 | 3614.050 | 3771.20 |
| 28 | 4087.30 | 4055.569 | 4272.51 |
| 32 | 4401.45 | 4375.675 | 4603.87 |
| 36 | 4687.40 | 4600.352 | 4805.67 |
| 42 | 4923.00 | 4812.135 | 4960.12 |
| 48 | 5067,99 | 4929.436 | 5024.45 |
Menggunakan data pada Tabel 4 , grafik aktivitas protease eksperimental dan terprediksi versus waktu diplot, seperti yang digambarkan pada Gambar 8. Jelaslah bahwa model Gompertz yang dimodifikasi memprediksi aktivitas protease eksperimental lebih berhasil dibandingkan dengan model logistik yang dimodifikasi selama tahap awal produksi. Namun, perbedaan ini menurun antara 10 dan 20 jam produksi dan kedua model memberikan prediksi yang lebih dekat. Bertentangan dengan model Gompertz yang dimodifikasi, model logistik yang dimodifikasi memprediksi aktivitas eksperimental lebih tepat pada tahap akhir produksi. Selain itu, nilai aktivitas protease eksperimental maksimum diprediksi oleh model logistik yang dimodifikasi dengan kesalahan yang lebih sedikit dibandingkan dengan model Gompertz yang dimodifikasi.
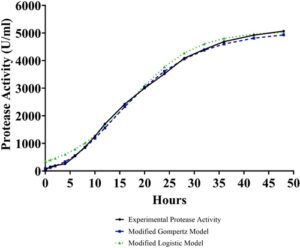
Kekuatan representasi model dievaluasi dengan perhitungan RMSE, MAE, R 2 , B f , A f dan nilai kemiringan. Seperti yang disajikan dalam Tabel 6 , model Gompertz yang dimodifikasi memiliki kesalahan yang lebih rendah, dan nilai R 2 , B f , A f dan kemiringan lebih dekat ke 1 dibandingkan dengan model logistik yang dimodifikasi. Dapat disimpulkan bahwa model Gompertz yang dimodifikasi dapat digunakan dengan sukses untuk merepresentasikan produksi protease dengan B. licheniformis NRS 1264; namun, model logistik yang dimodifikasi lebih disukai untuk prediksi nilai aktivitas protease maksimum.
| Parameter statistik | Model Gompertz yang dimodifikasi | Model logistik yang dimodifikasi |
|---|---|---|
| RMSE | 77.419 | Nomor telepon 207.114 |
| MAE | 65.884 | 179.691 |
| R 2 | 0,999 | 0,995 |
| Bf atau Bf | 0.812 | 0,556 |
| Sebuah f | 1.323 | 1.828 |
KESIMPULAN
Studi ini menyajikan investigasi komprehensif ke dalam karakterisasi, optimasi dan pemodelan matematika produksi protease oleh Bacillus licheniformis NRS 1264, menunjukkan potensinya untuk aplikasi industri. Studi karakterisasi mengungkapkan bahwa enzim menunjukkan aktivitas optimal pada 55 °C dan pH 5,5, dengan MnSO4 meningkatkan aktivitas sebesar 37%, sementara CoCl2 dan EDTA menurunkan aktivitas masing-masing sebesar 20% dan 37%. Selain itu, enzim mempertahankan 95% dari aktivitas maksimumnya setelah 30 hari pada suhu 4 °C, menyoroti stabilitasnya yang tinggi. Juga, studi optimasi secara signifikan meningkatkan produksi protease, dengan aktivitas enzim maksimum 5078 U mL −1 , sekitar empat kali lipat lebih tinggi dari aktivitas terendah yang diperoleh dalam percobaan OFAT. Lebih jauh, pemodelan matematika menunjukkan bahwa model Gompertz yang dimodifikasi merepresentasikan produksi protease lebih akurat, menunjukkan tingkat kesalahan yang lebih rendah dan daya prediksi yang lebih kuat dibandingkan dengan model logistik yang dimodifikasi. Temuan ini tidak hanya memperkuat potensi industri protease ini tetapi juga menyediakan data berharga untuk mendukung komersialisasi masa depannya untuk aplikasi bioteknologi.
